随着病毒生物学的发展,诸多病毒载体已成为了在各种实验中进行核酸转运的重要工具,主流的病毒载体主要包括:慢病毒、逆转录病毒、腺病毒和腺相关病毒。其中,慢病毒的应用很为广泛。
什么是慢病毒?
慢病毒的英文是Lentivirus,它的命名有两层含义。一方面,Lenti-在拉丁文中有慢的意思;另一方面,被慢病毒感染的患者早期很难观察,大多都会经历一个长达数年的潜伏期,之后才缓慢发病,因此这些病原微生物被称之为慢病毒。
它是逆转录病毒科下的一个属,其主要包括8种能够感染人和脊椎动物的病毒,原发感染的细胞以巨噬细胞和淋巴细胞为主,导致感染个体发病。其典型特征为其RNA基因组能逆转录为cDNA副本,cDNA副本又能稳定整合至宿主细胞基因组中(这就是常说的稳转)。
慢病毒的基因组都很复杂,编码一系列不同于其他逆转录病毒的调控蛋白,这使得它们具有独特的调控途径和病毒持久性机制。
慢病毒的基因结构
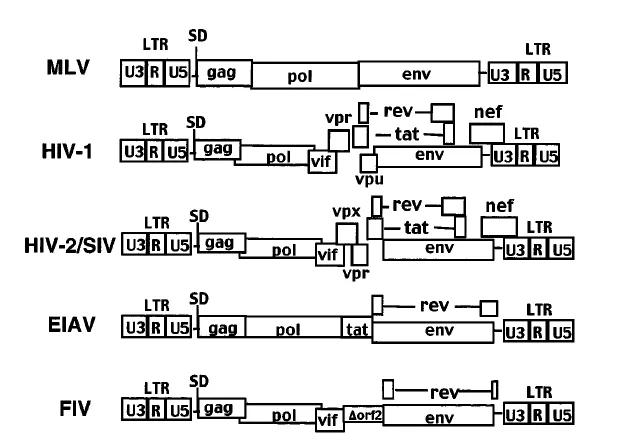
所有的逆转录病毒都至少含有这三种基因:gag、pol和env,它们编码结构蛋白和酶(逆转录酶,RNase H,整合酶,和蛋白酶),这是病毒复制所必要的。然而,慢病毒包含额外的基因,这些基因对于有效的病毒复制和持久性是必不可少的。如原型慢病毒HIV-1,编码了6个额外的基因(tat、rev、vif、vpu、vpr和nef)。HIV-2和SIV缺乏vpu基因,但包含一个叫做vpx的基因。非灵长类的慢病毒含有较少的这些额外基因,但都包含了tat和rev基因,它们分别负责转录和转录激活病毒基因表达。
HIV-1作为慢病毒的代表,其结构具有一定的特点。它是一个单链的RNA病毒,其由9个基因所构成,gag、pol、env3个基因编码病毒的基本结构,tat、rev2个调节基因,vif、vpr、vpu、nef 4个辅助基因。gap基因可以编码病毒所需的核心蛋白;pol基因编码病毒复制所需要的酶;env基因编码病毒的包膜糖蛋白,并且可以决定病毒感染宿主的靶向性。rev基因编码的蛋白调节gag、pol、env的表达水平,tat编码的蛋白参与RNA转录的调节,此外两端为长末端重复系列,一般简称其为LTR,内含复制所需的顺式作用原件。
慢病毒的特点
1. 感染范围广
慢病毒可有效感染分裂和非分裂细胞,适合几乎所有细胞系,如神经元细胞、肝细胞、心肌细胞、肿瘤细胞、内皮细胞、干细胞等。
2. 可稳定表达
慢病毒可将外源基因整合到宿主细胞基因组上,不随着细胞的分裂传代而丢失,大大提高目的基因或目的shRNA的转导效率,能够方便快捷地实现基因的长期、稳定表达。
3. 操作安全性高
慢病毒采用的是自失活复制缺陷型病毒株,保障操作安全。
慢病毒的应用
通常,对慢病毒的利用,更多是通过慢病毒载体来进行的。慢病毒载体是以HIV-1(人类免疫缺陷I型病毒)为基础发展起来的基因治疗载体,该载体可以将外源基因有效地整合到宿主的染色体上,从而达到外源基因的持久性表达。此外,这一载体区别于一般的逆转录病毒载体,即可以将转基因技术整合到分裂和非分裂细胞的基因组中。
慢病毒载体包含了包装、感染、稳定整合所需要的全部遗传信息,是慢病毒载体系统的主要组成部分。携带有外源基因的慢病毒载体在慢病毒包装质粒、细胞系的辅助下,经过病毒包装成为有感染力的病毒颗粒,将其进行收集和浓缩后可直接感染宿主细胞或者动物模型,实现外源基因在细胞或活体组织中表达。
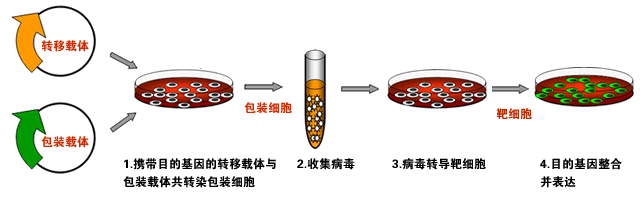
许多研究者在研究基因功能时,会进行基因干扰和基因过表达,让实验结论更严谨。基因过表达和干扰分别是指通过慢病毒感染细胞的方式,使目的细胞过量表达或沉默某特定基因,从而实现基因的功能增强或减弱。基因过表达和干扰作为一种传统的分子生物学技术至今依然在生物学研究中发挥着重要作用。
我们针对难转染的细胞,建立了标准的转基因技术服务体系,可为您提供过表达、干扰稳转细胞株的构建服务。结合有效的慢病毒系统,我们可以准确地将您的目的基因和示踪基因插入到目的细胞基因组中,得到稳定表达或沉默特定基因的细胞株。
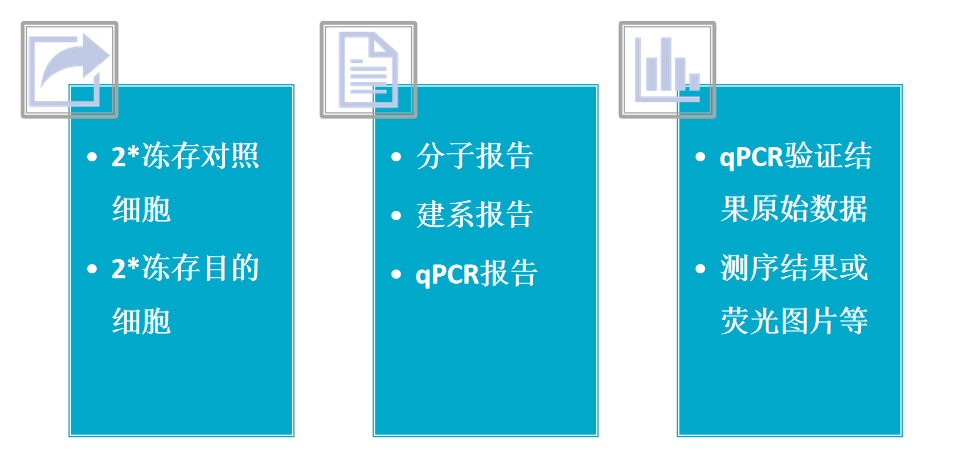
实验交付材料:
 上海中乔新舟生物科技有限公司
上海中乔新舟生物科技有限公司